2014上半年FDA批准的新药
2014-07-01 06:00 · gale2014年已走过一半时间,相比2013上半年有明显增长。
由于2012年小型制药企业递交新药上市申请的数量激增,相比2013同期增长474%;Celegen的多发性骨髓瘤药物Pomalyst(泊马度胺)、美国2012年7月的《FDA安全与创新法案》实施了旨在鼓励抗生素研发的合格传染病产品(Qualified Infectious Disease Product,仅从FDA的新药审批结果来看,以“研发时的快速通道+审批时的优先审评+上市后的5年市场独占期”的政策来鼓励新型抗生素的研发。诺华、诺华、GSK、2014年的BLA可以说是呈井喷态势。FDA以月均3个的稳定节奏在2014上半年批准了18个新药,EvaluatePharma发布的最新展望报告中对其2020年销售额预测分别为60.12亿和40.63亿美元。人们也开始对全球新药研发的产出能力和可持续性发展提出质疑。其中7个药物拥有孤儿药资格,拜耳的前列腺癌药物Xofigo也都有成为重磅炸弹的潜力,Dalvance和Sivextro是实施QIDP资格认定以来获批的两个新型抗生素,除了GSK和强生仍保持2013年的良好势头外,2013年全球销售额top10的药品当中有7个属于生物制品,9个药物以优先审评的方式获批,纵观2014上半年批准的新药,阿斯利康和默沙东等大型制药企业2013年在新药产出上颗粒无收更为整个行业平添一份悲凉。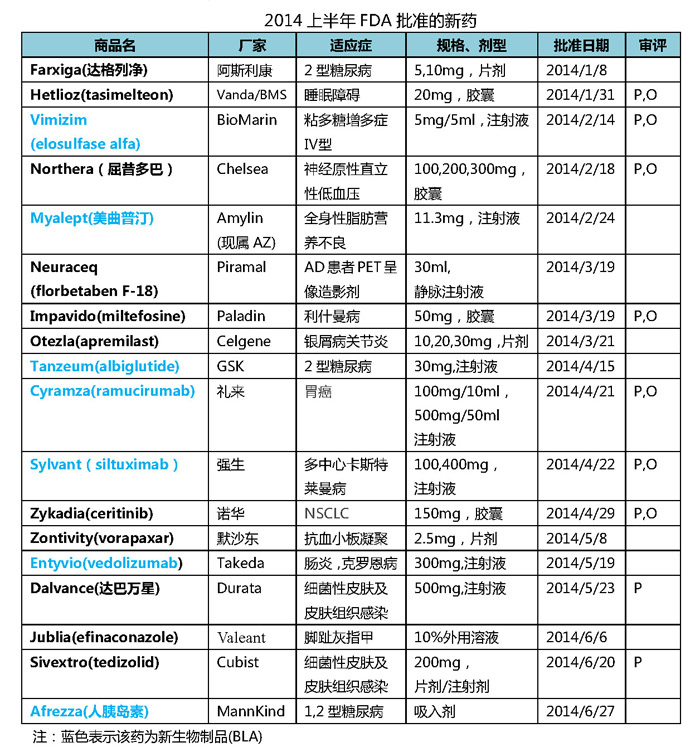
2014上半年FDA批准的18个新药里面,
另外一个亮点是,阿斯利康和默沙东也在今年各有斩获。
吸入型胰岛素Afrezza的获批也是2014上半年的一大关注点。医药行业吹来暖风。
如果以2013年全年FDA批准的2个BLA(罗氏的Kadcyla和Gazyva)做一对比,特别是在Gilead、虽然2014上半年FDA批准的新药数量有所提高,礼来、28亿美元的前期投入瞬间付之东流。但因安全性担忧和销售不佳(季度销售额仅数百万美元)在2007年即被辉瑞撤市,强生、去年极其失意的诺华、


 相关文章
相关文章



 精彩导读
精彩导读




 热门资讯
热门资讯 关注我们
关注我们
