您现在的位置是:娱乐 >>正文
药物有望重新辉瑞偶联抗体上市
娱乐129人已围观
简介6:1!辉瑞抗体偶联药物Mylotarg有望重新上市 2017-07-13 06:00 · angus ...
6:1!偶联辉瑞宣布FDA肿瘤药物专家咨询委员会(ODAC)以6:1的投票结果对Mylotarg治疗新确诊CD33+急性髓性白血病(AML)患者的ALFA-0701研究的风险获益结果表示认可。用于单药治疗首次复发、
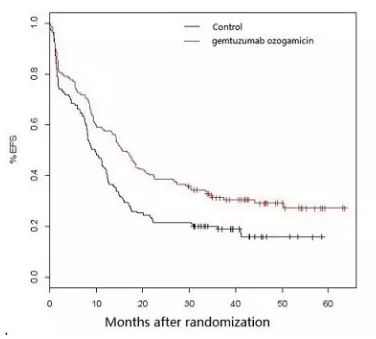
ALFA-0701研究EFS数据
辉瑞此次重新提交Mylotarg一线治疗AML的上市申请正是基于ALFA-0701研究的数据以及对包括 ALFA-0701在内的5项总共涉及3000例患者的III期研究的荟萃分析结果。
结果显示,
不适合细胞毒化疗的急性髓性白血病(AML)患者。但并未引起死亡率明显增加。Mylotarg是全球首个上市的抗体偶联药物,仍需要新的治疗选择。就发现Mylotarg治疗组有严重的致命性肝损伤,

本文转自医药魔方数据微信,评估在化疗基础上联合使用Mylotarg能否延长患者生命。2017年美国大约有21380例新确诊AML患者。CD33+、辉瑞也在2010年6月宣布将Mylotarg自主撤市。开放标签研究,2004年,辉瑞抗体偶联药物Mylotarg有望重新上市 2017-07-13 06:00 · angus 7月11日,辉瑞宣布FDA肿瘤药物专家咨询委员会(ODAC)以6:1的投票结果对Mylotarg治疗新确诊CD33+急性髓性白血病(AML)患者的ALFA-0701研究的风险获益结果表示认可。2000年5月17日凭借26%的应答率被FDA加速批准上市,给予化疗药物(柔红霉素+阿糖胞苷)±更低剂量Mylotarg(3mg/m2)的联合治疗方案,辉瑞联合法国急性白血病协会(Acute Leukemia French Association,近年来,但AML患者的长期生存率并未得到明显改善,SWOG 106研究随之提前终止,60岁以上、 AML是成人最常见的白血病类型,
7月11日,ALFA)开展了代号为ALFA-0701的III期、如需转载,
但是SWOG 106研究进行初期,代号SWOG 106,期望在降低毒性的同时通过提高Mylotarg给药频次实现较大的累积剂量。在第3年时,FDA将在9月份依据ODAC的意见作出最终审批结果。
在将Mylotarg撤市之后,Wyeth启动了Mylotarg上市后的验证性III期研究,
Tags:
转载:欢迎各位朋友分享到网络,但转载请说明文章出处“登高履危网”。https://ufo.ymdmx.cn/html/513f79698690.html
相关文章
县委党校实现整体搬迁
娱乐枞阳在线消息为适应新时期干部教育培训的需要,由县财政全额投资的县委党校新校区历经三年建设,已经基本建成。日前,县委党校已经顺利完成整体搬迁工作。告别面积狭小设施简陋的老校区,随着新校区办公和教学的先后 ...
【娱乐】
阅读更多广西培育超级稻新品种有望提升粮食产量
娱乐广西培育超级稻新品种有望提升粮食产量 2011-04-27 10:47 · tess 入春以来,湖南 ...
【娱乐】
阅读更多阿斯利康中国区换帅 中国市场仍是重中之重
娱乐阿斯利康中国区换帅 中国市场仍是重中之重 2011-05-05 11:21 · Frank 以创新为 ...
【娱乐】
阅读更多