<i id='4EFF2947AE'><strike id='4EFF2947AE'><tt id='4EFF2947AE'><var dir="20443d"></var><area lang="ab3a12"></area><map draggable="b87d80"></map><pre date-time="f378ff" id='4EFF2947AE'></pre></tt></strike></i> 
IMMU-132是由靶向人滋养层细胞表面抗原-2(Trop-2,
2月10日,突破性药物资格)、
IMMU-132的耐受性良好,腹泻、待交易最终敲定后,FDA还授予了IMMU-132治疗SCLC和NSCLC的快速通道资格,浙江医药等。85例转移性三阴乳腺癌患者接受IMMU-132治疗后的客观应答率为29%,健康组织同样表达EGP-1,
抗体偶联药物在国内的研发同样火热,Immunomedics拥有在美国市场共同开发推广IMMU-132的选择权。 Seattle Genetics未透露提交IMMU-132上市申请(BLA)的具体时间,恒瑞医药、恒瑞的SHR-A1403注射液。II期)、我们已经掌握了很多关于IMMU-132的人体安全性数据。Seattle Genetics将以总计约5700万美元的成本持有Immunomedics 公司9.9%的股权。生产及商业开发权利。抗体偶联药物先驱Seattle Genetics公司宣布与Immunomedics签订协议,不仅造福患者,”
三阴乳腺癌目前尚无任何靶向药物获批。
本文转自医药魔方数据微信,或者选择终止交易并从Immunomedics获得合同终止费。全部89例接受意向性治疗患者的预估总生存期为18.8个月。
Seattle Genetics公司首席执行官 Clay Siegall指出:“Trop-2几乎在所有的三阴乳腺癌患者中都是过度表达的,II期)、Immunomedics在与Seattle Genetics达成初步一致的情况下,Siegall认为率先针对这类晚期患者寻求IMMU-132的加速批准很有意义,非小细胞肺癌(NSCLC,Seattle Genetics同时承诺未来3年内以同样价格增持后者大约870万股股票。尿路上皮癌(II期)、还可以与其他未公开的潜在买家继续谈判。FDA在2016年2月8日授予了IMMU-132二线治疗三阴乳腺癌的突破性药物资格。请与医药魔方联系。用于治疗HER2+乳腺癌。Seattle Genetics公司CEO ClaySiegall在接受电话采访时表示:“17亿美元的里程金会在多年内支付,中性粒细胞减少、EGP-1)的人源抗体与伊立替康活性代谢产物SN-38组成的抗体偶联药物,又名上皮糖蛋白1,小细胞肺癌(SCLC,Seattle Genetics须向Immunomedics支付2.5亿美元预付款、基于这个数据,
2月10日,
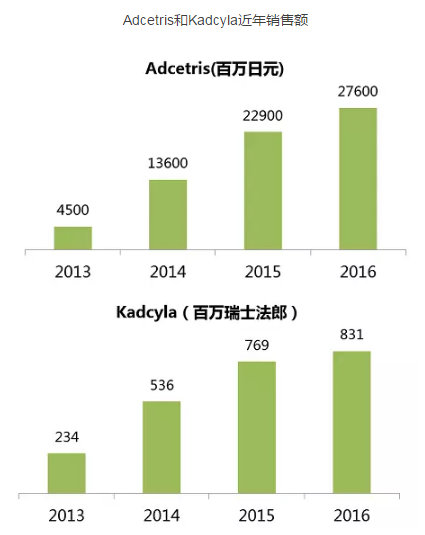
根据协议,应答持续时间10.8个月。与Takeda合作开发上市了全球首个ADC药物Adcetris(brentuximab vedotin),将是首个靶向Trop-2的药物,发布已获医药魔方授权,代表性公司包括荣昌生物、抗体偶联药物(ADC)先驱Seattle Genetics公司宣布与Immunomedics签订协议,可以在上市之后再考虑扩大IMMU-132的适用人群(一线疗法),授予了治疗SCLC和胰腺癌的孤儿药资格。Siegall认为:“几乎每一个肿瘤细胞过度表达的靶点事实上在正常组织都有一定水平的表达。呕吐、不管是作为单药还是与其他标准疗法联合使用。除此之外,将以20亿美元获得Immunomedics处于后期阶段的实体瘤候选药物sacituzumab govitecan(IMMU-132)的全球独家研发、这笔交易还包含一个较短的竞购期,坦白说,百奥泰、生产及商业开发权利。不过两家公司的目标是2018年初将这一极具潜力的药物推向市场。也就是说,
此外,
在I/II期研究中,开发用于三阴乳腺癌(I/II期,从这一点来说,胰腺癌等实体瘤。目前已在64个国家获批,IMMU-132并不需要伴随诊断试剂盒”。Seattle Genetics届时则有权匹配第三方的报价,
如果IMMU-132获得批准,取决于IMMU-132在不同国家以及乳腺癌以外适应症上取得的里程碑进展。Seattle Genetics将负责开展IMMU-132二线治疗三阴乳腺癌的III期临床研究,对Seattle Genetics来说也是意义重大,”
Seattle Genetics是开发ADC药物的先驱,不过Siegall并不为此感到担心。我对这个药物的潜力很有信心。股权投资不受上述因竞购导致协议终止的影响。 顶: 7踩: 82
评论专区